《安徽省2019年中考化學(xué)復(fù)習(xí) 第一篇 基礎(chǔ)過(guò)關(guān)篇 專(zhuān)項(xiàng)03 質(zhì)量守恒定律練習(xí)》由會(huì)員分享�����,可在線(xiàn)閱讀�,更多相關(guān)《安徽省2019年中考化學(xué)復(fù)習(xí) 第一篇 基礎(chǔ)過(guò)關(guān)篇 專(zhuān)項(xiàng)03 質(zhì)量守恒定律練習(xí)(10頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索。
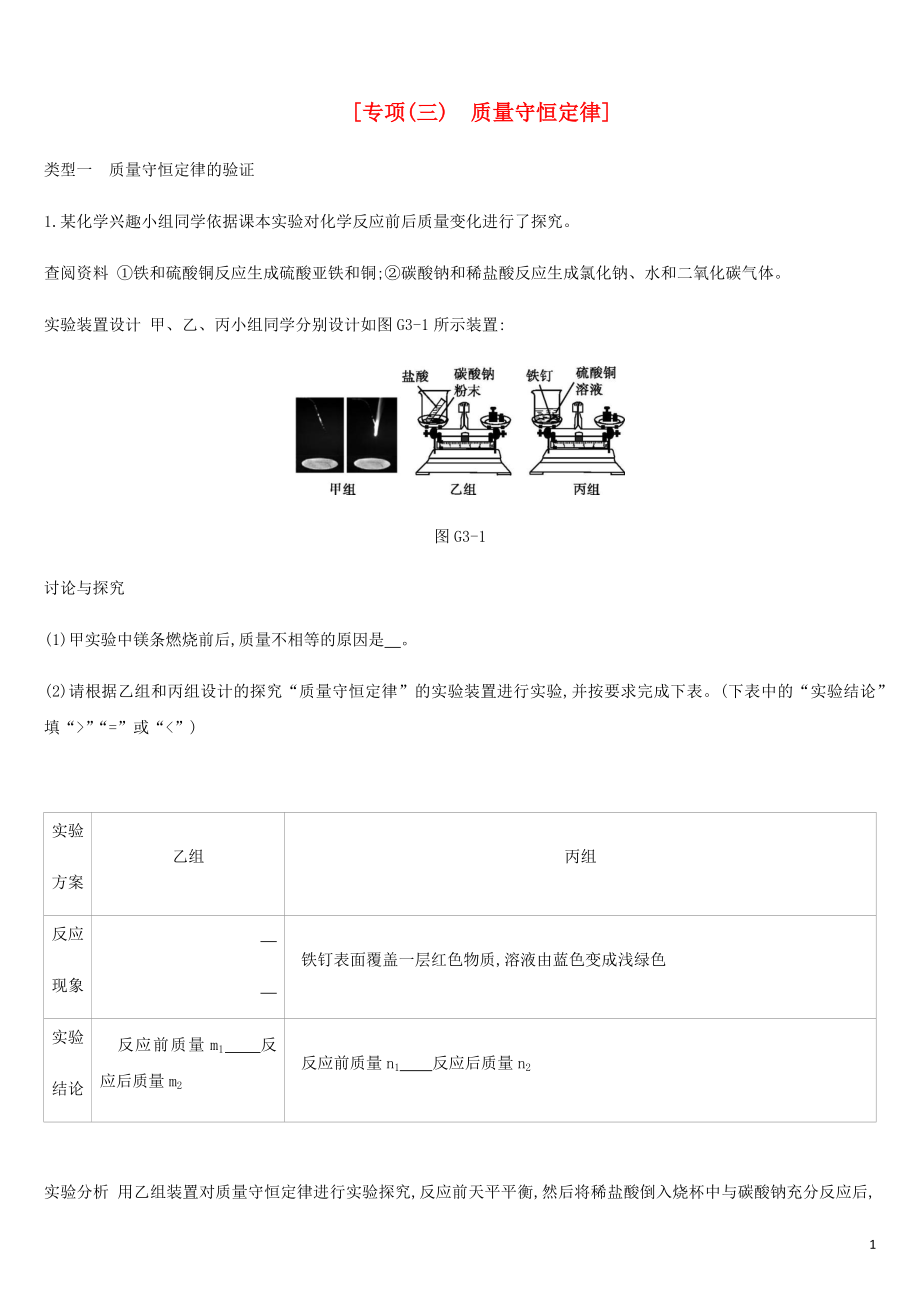
1��、專(zhuān)項(xiàng)(三) 質(zhì)量守恒定律類(lèi)型一質(zhì)量守恒定律的驗(yàn)證1.某化學(xué)興趣小組同學(xué)依據(jù)課本實(shí)驗(yàn)對(duì)化學(xué)反應(yīng)前后質(zhì)量變化進(jìn)行了探究�。查閱資料 鐵和硫酸銅反應(yīng)生成硫酸亞鐵和銅;碳酸鈉和稀鹽酸反應(yīng)生成氯化鈉、水和二氧化碳?xì)怏w�����。實(shí)驗(yàn)裝置設(shè)計(jì) 甲���、乙��、丙小組同學(xué)分別設(shè)計(jì)如圖G3-1所示裝置:圖G3-1討論與探究 (1)甲實(shí)驗(yàn)中鎂條燃燒前后,質(zhì)量不相等的原因是���。(2)請(qǐng)根據(jù)乙組和丙組設(shè)計(jì)的探究“質(zhì)量守恒定律”的實(shí)驗(yàn)裝置進(jìn)行實(shí)驗(yàn),并按要求完成下表。(下表中的“實(shí)驗(yàn)結(jié)論”填“”“=”或“=實(shí)驗(yàn)分析 右遵守產(chǎn)生的二氧化碳?xì)怏w逸到空氣中使燒杯中物質(zhì)的質(zhì)量減小實(shí)驗(yàn)結(jié)論 參加化學(xué)反應(yīng)的各物質(zhì)質(zhì)量總和等于生成的各物質(zhì)質(zhì)量總和反思與交
2���、流 有氣體參加或生成的反應(yīng),應(yīng)該在密閉容器中進(jìn)行實(shí)驗(yàn)解析 根據(jù)題給查閱資料 可知碳酸鈉和稀鹽酸反應(yīng)生成二氧化碳?xì)怏w,故可觀察到乙組實(shí)驗(yàn)燒杯冒出氣泡,因乙組實(shí)驗(yàn)產(chǎn)生的氣體散逸到空氣中,故反應(yīng)后的總質(zhì)量比反應(yīng)前的總質(zhì)量減輕了,丙組實(shí)驗(yàn)反應(yīng)前后既沒(méi)有氣體參加,也沒(méi)有氣體生成,所以反應(yīng)前后總質(zhì)量不變;通過(guò)對(duì)甲�����、乙�����、丙小組實(shí)驗(yàn)的探究不難得到如下啟示:用有氣體參加或產(chǎn)生的反應(yīng)驗(yàn)證質(zhì)量守恒定律時(shí)必須在密閉的容器中進(jìn)行����。2.(1)2Mg+O22MgO(2)反應(yīng)生成的氧化鎂部分?jǐn)U散到空氣中(3)實(shí)驗(yàn)探究 收集產(chǎn)物中的黃色固體放入試管中,加入適量的水,在試管口放一張濕潤(rùn)的紅色石蕊試紙有刺激性氣味的氣體生成,試紙由
3����、紅色變藍(lán)色證明黃色固體是Mg3N2反思與交流 -3氮?dú)饣瘜W(xué)性質(zhì)不如氧氣活潑燃燒不一定需要有氧氣參加解析(1)鎂條燃燒生成氧化鎂,化學(xué)方程式為2Mg+O22MgO。(2)鎂條燃燒的同時(shí)產(chǎn)生大量白煙,氧化鎂擴(kuò)散到空氣中,使收集的產(chǎn)物不全�。所以在石棉網(wǎng)上收集到產(chǎn)物的質(zhì)量小于鎂條的質(zhì)量。(3)實(shí)驗(yàn)探究 根據(jù)查閱的資料可知,氮化鎂可與水劇烈反應(yīng)產(chǎn)生氨氣,氨氣能使?jié)駶?rùn)的紅色石蕊試紙變藍(lán);可以取少量黃色粉末放入試管內(nèi),加入少量水,觀察到有刺激性氣味的氣體生成,將濕潤(rùn)的紅色石蕊試紙放在試管口,試紙變藍(lán),則說(shuō)明黃色粉末是氮化鎂��。反思與交流 化合物中各元素正負(fù)化合價(jià)的代數(shù)和為零,設(shè)氮化鎂中N元素的化合價(jià)為x,(+
4���、2)3+2x=0,x=-3���。空氣中N2的含量遠(yuǎn)大于O2的含量,可是鎂條在空氣中燃燒生成的產(chǎn)物MgO卻遠(yuǎn)多于Mg3N2,原因是氧氣遠(yuǎn)比氮?dú)庑再|(zhì)活潑,Mg更容易與氧氣反應(yīng)�����。鎂在點(diǎn)燃條件下能與氮?dú)夥磻?yīng),氫氣在氯氣中能夠燃燒,可知燃燒不一定需要氧氣。3.B解析 根據(jù)質(zhì)量守恒定律可知,參加反應(yīng)的B的質(zhì)量為28g+2g12g=18g�����。4.C解析 根據(jù)質(zhì)量守恒定律可知化學(xué)反應(yīng)前后原子種類(lèi)和數(shù)目不變,反應(yīng)前O6個(gè),反應(yīng)后C2個(gè),H8個(gè),O8個(gè),因此2X中含有2個(gè)C,8個(gè)H和2個(gè)O,X的化學(xué)式為CH3OH���。5.C解析 根據(jù)質(zhì)量守恒定律可知,化學(xué)反應(yīng)前后元素種類(lèi)不變,因此推知該物質(zhì)中一定含碳元素和氫元素,可能含氧
5��、元素���。8.8gCO2中含碳元素質(zhì)量為8.8g1244=2.4g;5.4gH2O中含氫元素質(zhì)量為5.4g218=0.6g,碳元素與氫元素質(zhì)量比為2.4g0.6g=41,物質(zhì)的分子中碳原子和氫原子個(gè)數(shù)比為2.4120.61=0.20.6=13。6.D解析 由微觀示意圖可知,該反應(yīng)的化學(xué)方程式為2O2+CH42H2O+c�。根據(jù)化學(xué)反應(yīng)前后原子的種類(lèi)、個(gè)數(shù)不變可知,c的化學(xué)式為CO2;該反應(yīng)前后元素的種類(lèi)��、質(zhì)量不發(fā)生變化,符合質(zhì)量守恒定律;由化學(xué)方程式可知,2個(gè)氧分子和1個(gè)甲烷分子反應(yīng),生成2個(gè)水分子和1個(gè)二氧化碳分子,反應(yīng)前后分子個(gè)數(shù)保持不變����。7.B解析 該反應(yīng)中的兩種反應(yīng)物都是化合物,不屬于置換反
6、應(yīng)�����。8.A解析 碳和過(guò)量的氧氣充分反應(yīng)生成二氧化碳,反應(yīng)方程式為C+O2CO2,氣體的分子數(shù)即化學(xué)計(jì)量數(shù),所以反應(yīng)前后氣體的分子數(shù)不變;碳和氧氣生成二氧化碳,氣體的質(zhì)量增加不會(huì)減少;因?yàn)檠鯕膺^(guò)量,所以碳反應(yīng)完了,固體質(zhì)量最后為零;根據(jù)質(zhì)量守恒定律反應(yīng)前后物質(zhì)的總質(zhì)量不變,該反應(yīng)在一密閉容器中,所以物質(zhì)總質(zhì)量一直不變。9.B解析 根據(jù)質(zhì)量守恒定律可知,x=0.4;甲和乙的質(zhì)量減少,是反應(yīng)物;反應(yīng)中甲�����、丙發(fā)生改變的質(zhì)量比是4.45.6=1114;從已知條件看,不能確定丁是單質(zhì)����。10.D解析 根據(jù)對(duì)比反應(yīng)前后物質(zhì)的質(zhì)量可知,a、b質(zhì)量增大,為生成物,c質(zhì)量減小,為反應(yīng)物,d不變,可能是催化劑也可能與
7�����、反應(yīng)無(wú)關(guān),故該反應(yīng)表達(dá)式可表示為ca+b或ca+b,根據(jù)現(xiàn)有條件無(wú)法比較b���、a的相對(duì)分子質(zhì)量大小,根據(jù)質(zhì)量守恒定律可知,參加反應(yīng)的c的質(zhì)量一定等于生成a、b的質(zhì)量之和�。11.D解析 根據(jù)質(zhì)量守恒定律,反應(yīng)后丙的質(zhì)量為4g+10g+3g+4g-(6g+4g+8g)=3g,故乙為反應(yīng)物,甲、丁為生成物,丙可能為催化劑,可能與反應(yīng)無(wú)關(guān),該反應(yīng)為分解反應(yīng);參加反應(yīng)的乙���、丁質(zhì)量比為(10g-4g)(8g-4g)=32;生成甲����、丁的質(zhì)量比為(6g-4g)(8g-4g)=12,由于無(wú)法確定化學(xué)方程式中各反應(yīng)物和生成物的化學(xué)計(jì)量數(shù),所以無(wú)法確定甲����、丁的相對(duì)分子質(zhì)量比����。12.(1)(2)N�����、C(3)34g(4)AC解析(1)每個(gè)一氧化氮分子由一個(gè)氮原子和一個(gè)氧原子構(gòu)成;(2)在氧化催化轉(zhuǎn)化器中,是一氧化碳和一氧化氮反應(yīng)生成二氧化碳和二氧化氮,碳元素和氮元素的化合價(jià)升高;(3)根據(jù)化學(xué)方程式CO(NH2)2+H2O2NH3+CO2603460gx6034=60gxx=34g(4)SCR催化轉(zhuǎn)換器可能將NH3和NO2轉(zhuǎn)化式N2;無(wú)污染的排出氣中還可能含有二氧化碳等其他無(wú)污染氣體;N2也可能是反應(yīng)之前進(jìn)入SCR催化轉(zhuǎn)換器的�����。10
 安徽省2019年中考化學(xué)復(fù)習(xí) 第一篇 基礎(chǔ)過(guò)關(guān)篇 專(zhuān)項(xiàng)03 質(zhì)量守恒定律練習(xí)
安徽省2019年中考化學(xué)復(fù)習(xí) 第一篇 基礎(chǔ)過(guò)關(guān)篇 專(zhuān)項(xiàng)03 質(zhì)量守恒定律練習(xí)