《2022高中化學(xué)(課堂同步系列二)每日一題 周末培優(yōu)2(含解析)新人教版選修4》由會員分享���,可在線閱讀����,更多相關(guān)《2022高中化學(xué)(課堂同步系列二)每日一題 周末培優(yōu)2(含解析)新人教版選修4(4頁珍藏版)》請在裝配圖網(wǎng)上搜索�。
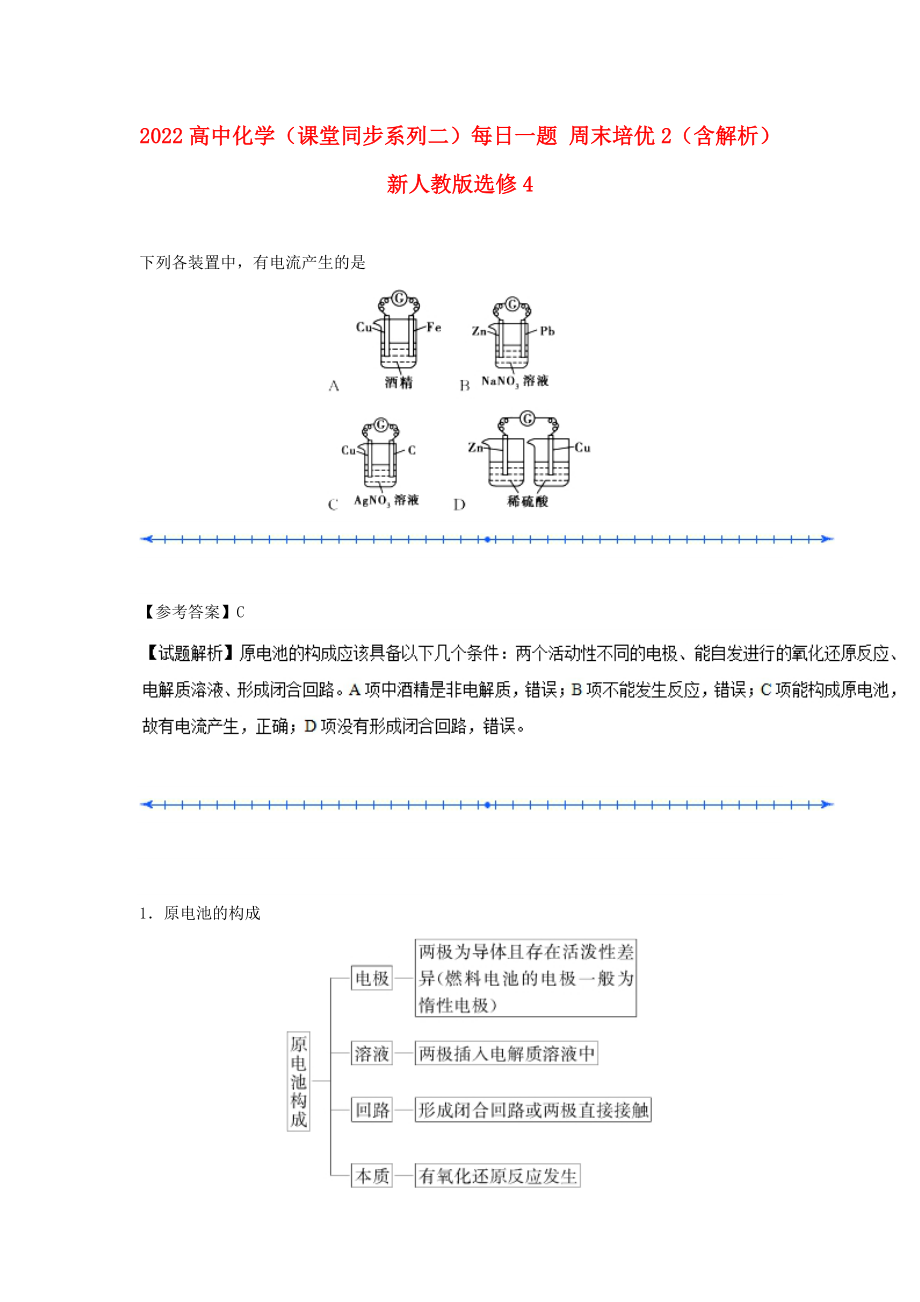
1、2022高中化學(xué)(課堂同步系列二)每日一題 周末培優(yōu)2(含解析)新人教版選修4 下列各裝置中����,有電流產(chǎn)生的是 【參考答案】C 1原電池的構(gòu)成 2實例:如圖是CuZn原電池 兩種裝置的比較:裝置中還原劑Zn與氧化劑Cu2直接接觸,易造成能量損耗�����;裝置能避免能量損耗��;裝置中鹽橋的作用是提供離子遷移通路����,導(dǎo)電。3工作原理 1如圖所示的銅鋅原電池中�����,銅電極為 A負極B質(zhì)量增加C發(fā)生還原反應(yīng)的一極D發(fā)生氧化反應(yīng)的一極2用鐵片與稀硫酸反應(yīng)制氫氣時����,下列不能使氫氣生成速率加快的是A加熱B不用稀硫酸,改用98%濃硫酸C加少量硫酸銅溶液D不用鐵片����,改用鐵粉3用Cu片�����、Al片和Cu (NO3)2溶液設(shè)計成原電池�����。
2����、下列有關(guān)該原電池的敘述不正確的是A由該原電池的工作原理不能比較Cu��、Al的金屬活動性的強弱B正極反應(yīng):Cu2+2e-CuC其他條件不變��,將Cu片改為Ag片���,當(dāng)外電路中通過等量的電子時�����,Ag片溶解的質(zhì)量大于Cu片的D其他條件不變�,將Cu(NO3)2溶液改為FeCl3溶液�����,負極的電極反應(yīng)為Al-3e-Al3+4某研究性學(xué)習(xí)小組欲探究原電池的形成條件�,按如圖所示裝置進行實驗并得到如表所示實驗結(jié)果。 實驗序號AB燒杯中的液體靈敏電流表指針是否偏轉(zhuǎn)1ZnZn乙醇無2ZnCu稀硫酸有3ZnZn稀硫酸無4ZnCu苯無5CuC氯化鈉溶液有6MgAl氫氧化鈉溶液有分析題給數(shù)據(jù)�����,回答下列問題:(1)實驗2中電流由
3�����、 (填“A”或“B”�����,下同)極流向 極��。(2)實驗6中電子由B極流向A極����,表明負極是 (填“鎂”或“鋁”)電極。(3)實驗5表明 (填字母)�����。A銅在潮濕空氣中不會被腐蝕 B銅的腐蝕是自發(fā)進行的(4)分析表中有關(guān)信息����,下列說法不正確的是 (填字母)���。A相對活潑的金屬一定作負極B失去電子的電極是負極C燒杯中的液體必須是電解質(zhì)溶液D原電池中,浸入同一電解質(zhì)溶液中的兩個電極��,是活潑性不同的兩種金屬(或其中一種是非金屬導(dǎo)體) 1【答案】C 2【答案】B【解析】加熱升高溫度和增大固體反應(yīng)物的接觸面積都能加快化學(xué)反應(yīng)速率��,A�����、D正確�����;鐵在濃硫酸中鈍化����,不產(chǎn)生氫氣,B錯誤�����;加入少量硫酸銅溶液,由于Cu2Fe=
4��、CuFe2��,則構(gòu)成銅鐵稀硫酸原電池����,加快了鐵片與稀硫酸反應(yīng)制氫氣的速率�,C正確。3【答案】A 4【答案】(1)B A (2)鋁 (3)B (4)A【解析】(1)電流經(jīng)外電路由正極流向負極����,實驗2中,Cu為正極���,Zn為負極�����。(2)電子由負極流向正極�,實驗6中電子由B極流向A極�����,表明負極是鋁電極。(3)實驗5是銅的吸氧腐蝕���,說明銅的腐蝕是自發(fā)進行的����。(4)判斷原電池負極時�,不能簡單地比較金屬的活動性,要看反應(yīng)的具體情況�����,如Al在強堿性溶液中比Mg更易失電子�����,Al作負極���,Mg作正極����,A項說法不正確����;在原電池中負極失去電子�,發(fā)生氧化反應(yīng)���,B項說法正確�;燒杯中的液體必須是電解質(zhì)溶液���,C項說法正確�;活潑性不同的兩種金屬或一種金屬和一種非金屬導(dǎo)體都可以作電極�����,D項說法正確��。
 2022高中化學(xué)(課堂同步系列二)每日一題 周末培優(yōu)2(含解析)新人教版選修4
2022高中化學(xué)(課堂同步系列二)每日一題 周末培優(yōu)2(含解析)新人教版選修4