《北京市2018年中考化學(xué)基礎(chǔ)復(fù)習 專項突破(一)實驗原理分析之空氣中氧氣含量的測定練習》由會員分享�����,可在線閱讀�,更多相關(guān)《北京市2018年中考化學(xué)基礎(chǔ)復(fù)習 專項突破(一)實驗原理分析之空氣中氧氣含量的測定練習(3頁珍藏版)》請在裝配圖網(wǎng)上搜索。
1�����、專項突破(一) 實驗原理分析之空氣中氧氣含量的測定
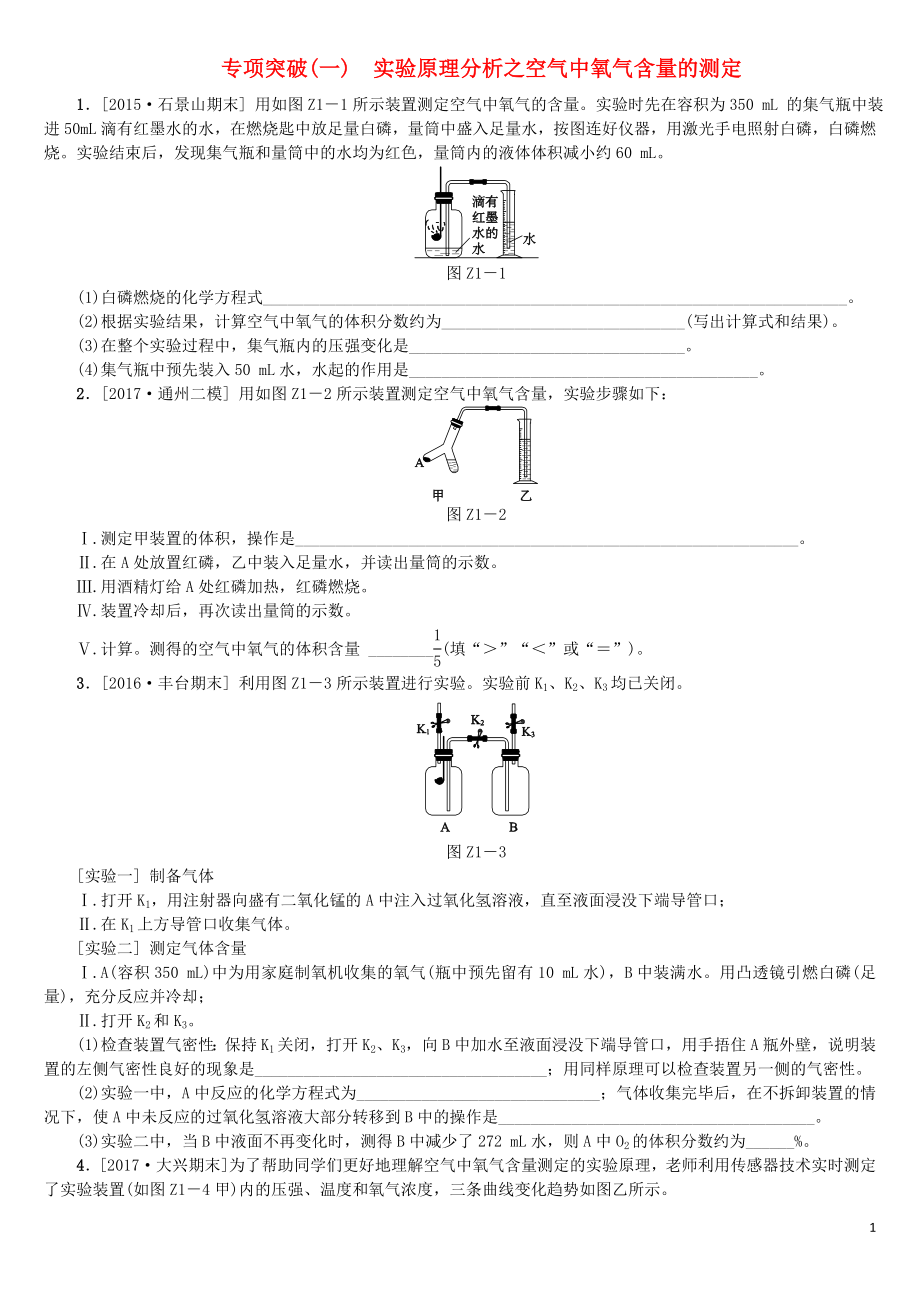
1.[2015·石景山期末] 用如圖Z1-1所示裝置測定空氣中氧氣的含量�����。實驗時先在容積為350 mL 的集氣瓶中裝進50 mL滴有紅墨水的水,在燃燒匙中放足量白磷����,量筒中盛入足量水,按圖連好儀器���,用激光手電照射白磷�,白磷燃燒�。實驗結(jié)束后����,發(fā)現(xiàn)集氣瓶和量筒中的水均為紅色,量筒內(nèi)的液體體積減小約60 mL�����。
圖Z1-1
(1)白磷燃燒的化學(xué)方程式________________________________________________________________________���。
(2)根據(jù)實驗結(jié)果��,計算空氣中氧氣的體積
2��、分數(shù)約為______________________________(寫出計算式和結(jié)果)����。
(3)在整個實驗過程中,集氣瓶內(nèi)的壓強變化是__________________________________�。
(4)集氣瓶中預(yù)先裝入50 mL水,水起的作用是___________________________________________����。
2.[2017·通州二模] 用如圖Z1-2所示裝置測定空氣中氧氣含量,實驗步驟如下:
圖Z1-2
Ⅰ.測定甲裝置的體積�����,操作是_________________________________________________________
3����、_____。
Ⅱ.在A處放置紅磷�����,乙中裝入足量水�,并讀出量筒的示數(shù)。
Ⅲ.用酒精燈給A處紅磷加熱�,紅磷燃燒。
Ⅳ.裝置冷卻后�����,再次讀出量筒的示數(shù)。
Ⅴ.計算�。測得的空氣中氧氣的體積含量 ________(填“>”“<”或“=”)。
3.[2016·豐臺期末] 利用圖Z1-3所示裝置進行實驗��。實驗前K1�、K2、K3均已關(guān)閉��。
圖Z1-3
[實驗一] 制備氣體
Ⅰ.打開K1�����,用注射器向盛有二氧化錳的A中注入過氧化氫溶液�,直至液面浸沒下端導(dǎo)管口��;
Ⅱ.在K1上方導(dǎo)管口收集氣體���。
[實驗二] 測定氣體含量
Ⅰ.A(容積350 mL)中為用家庭制氧機收集的氧氣(瓶中預(yù)先留有10
4�����、 mL水)�����,B中裝滿水��。用凸透鏡引燃白磷(足量)��,充分反應(yīng)并冷卻���;
Ⅱ.打開K2和K3����。
(1)檢查裝置氣密性:保持K1關(guān)閉�����,打開K2��、K3�,向B中加水至液面浸沒下端導(dǎo)管口,用手捂住A瓶外壁�,說明裝置的左側(cè)氣密性良好的現(xiàn)象是____________________________________;用同樣原理可以檢查裝置另一側(cè)的氣密性�。
(2)實驗一中,A中反應(yīng)的化學(xué)方程式為______________________________���;氣體收集完畢后��,在不拆卸裝置的情況下���,使A中未反應(yīng)的過氧化氫溶液大部分轉(zhuǎn)移到B中的操作是__________________________________
5����、_____����。
(3)實驗二中,當B中液面不再變化時���,測得B中減少了272 mL水��,則A中O2的體積分數(shù)約為______%�����。
4.[2017·大興期末] 為了幫助同學(xué)們更好地理解空氣中氧氣含量測定的實驗原理,老師利用傳感器技術(shù)實時測定了實驗裝置(如圖Z1-4甲)內(nèi)的壓強�、溫度和氧氣濃度,三條曲線變化趨勢如圖乙所示�����。
圖Z1-4
(1)紅磷燃燒的化學(xué)反應(yīng)方程式為____________________________。
(2)X曲線表示的是______________(填“溫度”或“氧氣的濃度”)����。
(3)結(jié)合X、Y兩條曲線����,解釋圖乙中BC段氣壓變化的原因是____________
6、________________________________����。
(4)實驗中測得的數(shù)據(jù)如下:
測量項目
實驗前
實驗后
燒杯中水的體積
燒杯中剩余水的體積
瓶中剩余氣體的體積
體積/mL
80.0
46.4
126.0
根據(jù)實驗數(shù)據(jù)計算:測得的空氣中氧氣的體積分數(shù)為__________________________________(列出計算式即可)。參考答案
1.(1)4P+5O22P2O5
(2)×100%=20%
(3)先變大����,后變小
(4)封住導(dǎo)管口、降溫��、吸收白煙
[解析] (1)白磷在空氣中燃燒生成五氧化二磷�,反應(yīng)的化學(xué)方程式為4P+5O
7、22P2O5��。(2)白磷燃燒消耗了集氣瓶內(nèi)的氧氣����,量筒內(nèi)減少的水的體積即為消耗的氧氣體積�,集氣瓶容積為350 mL���,且已裝進50 mL滴有紅墨水的水��,所以空氣中氧氣的體積分數(shù)約為×100%=20%���。(3)該實驗中,集氣瓶中的白磷燃燒時�����,溫度升高����,氣體壓強增大,當白磷燃燒完后�����,溫度降低���,氧氣被消耗��,氣體的壓強減小���,因此集氣瓶內(nèi)壓強變化的過程是先變大,后變小����。(4)測定空氣中氧氣的含
量的實驗中,集氣瓶內(nèi)預(yù)先裝入少量水���,目的是封住導(dǎo)管口����、降低溫度以及吸收生成的五氧化二磷��。
2.Ⅰ.將甲中充滿水���,再用量筒測量水的體積即為甲的體積(合理即可)
Ⅴ.>
3.(1)B裝置左側(cè)導(dǎo)管口有氣泡冒出
(2)2H2O22H2O+O2↑
打開K2���、K3,關(guān)閉K1
(3)80
4.(1)4P+5O22P2O5
(2)溫度
(3)紅磷燃燒放熱��,溫度升高����,壓強增大����,同時消耗氧氣���,使氣壓減?��。籅C段燃燒放熱造成的壓強增大強于氧氣減少造成的壓強減小
(4)×100%
3
 北京市2018年中考化學(xué)基礎(chǔ)復(fù)習 專項突破(一)實驗原理分析之空氣中氧氣含量的測定練習
北京市2018年中考化學(xué)基礎(chǔ)復(fù)習 專項突破(一)實驗原理分析之空氣中氧氣含量的測定練習