《2022年高三化學(xué)一輪復(fù)習(xí) 第52課時(shí) 分子空間結(jié)構(gòu)與物質(zhì)的性質(zhì)學(xué)案》由會(huì)員分享�,可在線閱讀�����,更多相關(guān)《2022年高三化學(xué)一輪復(fù)習(xí) 第52課時(shí) 分子空間結(jié)構(gòu)與物質(zhì)的性質(zhì)學(xué)案(3頁(yè)珍藏版)》請(qǐng)?jiān)谘b配圖網(wǎng)上搜索����。
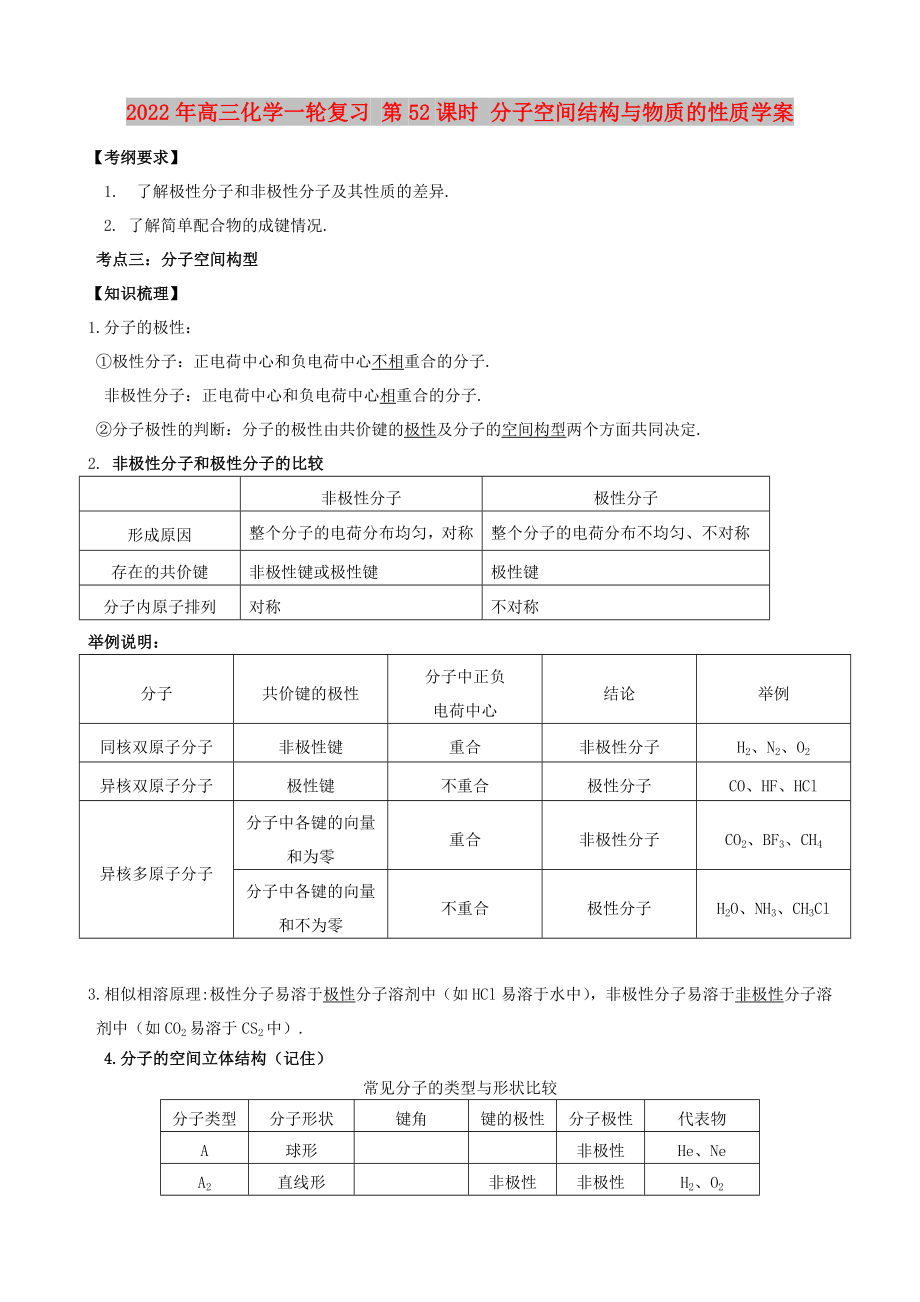
1、2022年高三化學(xué)一輪復(fù)習(xí) 第52課時(shí) 分子空間結(jié)構(gòu)與物質(zhì)的性質(zhì)學(xué)案【考綱要求】1. 了解極性分子和非極性分子及其性質(zhì)的差異.2. 了解簡(jiǎn)單配合物的成鍵情況.考點(diǎn)三:分子空間構(gòu)型 【知識(shí)梳理】1.分子的極性:極性分子:正電荷中心和負(fù)電荷中心不相重合的分子.非極性分子:正電荷中心和負(fù)電荷中心相重合的分子.分子極性的判斷:分子的極性由共價(jià)鍵的極性及分子的空間構(gòu)型兩個(gè)方面共同決定.2. 非極性分子和極性分子的比較非極性分子極性分子形成原因整個(gè)分子的電荷分布均勻�,對(duì)稱整個(gè)分子的電荷分布不均勻、不對(duì)稱存在的共價(jià)鍵非極性鍵或極性鍵極性鍵分子內(nèi)原子排列對(duì)稱不對(duì)稱舉例說(shuō)明:分子共價(jià)鍵的極性分子中正負(fù)電荷中心結(jié)
2����、論舉例同核雙原子分子非極性鍵重合非極性分子H2、N2���、O2異核雙原子分子極性鍵不重合極性分子CO����、HF�、HCl異核多原子分子分子中各鍵的向量和為零重合非極性分子CO2、BF3����、CH4分子中各鍵的向量和不為零不重合極性分子H2O���、NH3��、CH3Cl3.相似相溶原理:極性分子易溶于極性分子溶劑中(如HCl易溶于水中)���,非極性分子易溶于非極性分子溶劑中(如CO2易溶于CS2中).4.分子的空間立體結(jié)構(gòu)(記?。┏R?jiàn)分子的類型與形狀比較分子類型分子形狀鍵角鍵的極性分子極性代表物A球形非極性He��、NeA2直線形非極性非極性H2����、O2AB直線形極性極性HCl、NOABA直線形180極性非極性CO2���、CS2A
3���、BAV形180極性極性H2O、SO2A4正四面體形60非極性非極性P4AB3平面三角形120極性非極性BF3��、SO3AB3三角錐形120極性極性NH3���、NCl3AB4正四面體形10928極性非極性CH4��、CCl4AB3C四面體形10928極性極性CH3Cl����、CHCl3AB2C2四面體形10928極性極性CH2Cl2直 線三角形V形四面體三角錐V形 H2O【典型例題】5.根據(jù)科學(xué)人員探測(cè):在海洋深處的沉積物中含有可燃冰,主要成分是甲烷水合物.其組成的兩種分子的下列說(shuō)法正確的是 A.它們都是極性鍵形成的極性分子 B.它們都只有鍵 C.它們成鍵電子的原子軌道都是sp3-s D.它們的立體結(jié)構(gòu)都相同6
4、.下列分子既不存在s-p 鍵��,也不存在p-p 鍵的是 AHCl BHF CSO2 DSCl2 【變式訓(xùn)練】7.下列關(guān)于丙烯(CH3CH =CH2)的說(shuō)法正確的A丙烯分子有8個(gè)鍵��,1個(gè)鍵 B丙烯分子中3個(gè)碳原子都是sp3雜化C丙烯分子存在非極性鍵 D丙烯分子中3個(gè)碳原子在同一直線上考點(diǎn)二:配合物【知識(shí)梳理】概念表示條件共用電子對(duì)由一個(gè)原子單方向提供給另一原子共用所形成的共價(jià)鍵�。 A B電子對(duì)給予體 電子對(duì)接受體 其中一個(gè)原子必須提供孤對(duì)電子,另一原子必須能接受孤對(duì)電子的軌道����。8.配位鍵:一個(gè)原子提供一對(duì)電子與另一個(gè)接受電子的原子形成的共價(jià)鍵.即成鍵的兩個(gè)原子一方提供孤對(duì)電子,一方提供空軌道而形成
5�����、的共價(jià)鍵.9.配合物:由提供孤電子對(duì)的配位體與接受孤電子對(duì)的中心原子(或離子)以配位鍵形成的化合物稱配合物,又稱絡(luò)合物.形成條件:a.中心原子(或離子)必須存在空軌道. b.配位體具有提供孤電子對(duì)的原子.配合物的組成.配合物的性質(zhì):配合物具有一定的穩(wěn)定性.配合物中配位鍵越強(qiáng)���,配合物越穩(wěn)定.當(dāng)作為中心原子的金屬離子相同時(shí)����,配合物的穩(wěn)定性與配體的性質(zhì)有關(guān).【典型例題】10.下列不屬于配合物的是ACu(NH3)4SO4H2O BAg(NH3)2OHCKAl(SO4)212H2O DNaAl(OH) 411.向盛有硫酸銅水溶液的試管里加入氨水,首先形成難溶物�,繼續(xù)添加氨水,難溶物溶解得到深藍(lán)色的透明溶液.下列對(duì)此現(xiàn)象說(shuō)法正確的是 A反應(yīng)后溶液中不存在任何沉淀���,所以反應(yīng)前后Cu2+的濃度不變 B沉淀溶解后����,將生成深藍(lán)色的配合離子Cu(NH3)4 2+ C向反應(yīng)后的溶液加入乙醇�����,溶液沒(méi)有發(fā)生變化 D在Cu(NH3)4 2+離子中�,Cu2+給出孤對(duì)電子���,NH3提供空軌道
 2022年高三化學(xué)一輪復(fù)習(xí) 第52課時(shí) 分子空間結(jié)構(gòu)與物質(zhì)的性質(zhì)學(xué)案
2022年高三化學(xué)一輪復(fù)習(xí) 第52課時(shí) 分子空間結(jié)構(gòu)與物質(zhì)的性質(zhì)學(xué)案